自免CAR-T的四大技术路线
作者:admin 发布时间:2024-03-04 10:40
近日,随着CD19-CAR-T在自免领域最新临床数据在《NEJM》上的发布,这一条曾经不被看好赛道的前景也逐步明朗。
像红斑狼疮那样难以根治的自免疾病或许将因CAR-T而不再困难。
所有患者在接受治疗后的中位随访15个月内,都能够做到停止使用免疫抑制剂来进行后续治疗。甚至有患者在经过治疗2年之内,都没有再复发的迹象,可以说完全重建了B细胞,展现出了CAR-T潜在的持久性。
本文将梳理目前自免领域CAR-T的概览情况和未来发展方向,赛道竞争者,及其不同的开发方式。
自免CAR-T情况概览
从机制上来看,目前CAR-T在人体临床中所治疗的自身免疫病主要是B细胞介导的自身免疫病。
因为B细胞介导的自身免疫性疾病主要涉及B细胞的异常活化,异常活化的B细胞会产生大量的自身抗体,这些自身抗体攻击自身组织,导致组织损伤和疾病发生。
常用的疗法如利妥昔单抗,糖皮质激素一方面有药物依赖的问题,另一方面还常常会出现复发,甚至还有一些患者根本对传统疗法没有反应。
而CD19/BCMA等靶点的CAR-T能够直接靶向B细胞,可以通过清除现有B细胞,并诱发B细胞重建来实现治疗目的。而在CD19基础上的CD19/BCMA双靶点的逻辑有些类似癌症中的应用,双靶点可以同时靶向CD19+记忆B细胞和BCMA+浆细胞。
另外又有一种CAART仅针对携带某些自身抗原受体的免疫细胞,靶标相对特殊,并没有对所有B细胞进行免疫抑制。在使用CAAR-T细胞疗法治疗自身免疫性脑炎患者中已经观察到靶细胞成功裂解。
而对于T细胞介导的自身免疫性疾病,传统的CAR-T仍然因为会出现“T细胞自杀”问题而鲜有办法,目前看来可实践性不大,尚待T细胞肿瘤中临床实践的佳音。
针对这一问题,另外一种可能更有希望的技术路线则在于CAR-Tregs上。Treg细胞是一种天然存在的、具有免疫抑制功能的T细胞亚群,它们对于维持机体免疫耐受和防止自身免疫反应过度至关重要。CAR-Treg疗法旨在利用工程化改造后的Treg细胞,使其能够更精确地定向到自身免疫疾病的炎症部位或参与异常反应的特定细胞类型,并通过增强局部免疫抑制作用来控制和缓解自身免疫反应。
而CAR-Tregs就可以针对主要由T细胞介导的自身免疫性疾病,如1型糖尿病,GvHD(移植物抗宿主病)等。扩充了CAR在自身免疫病领域的应用格局。
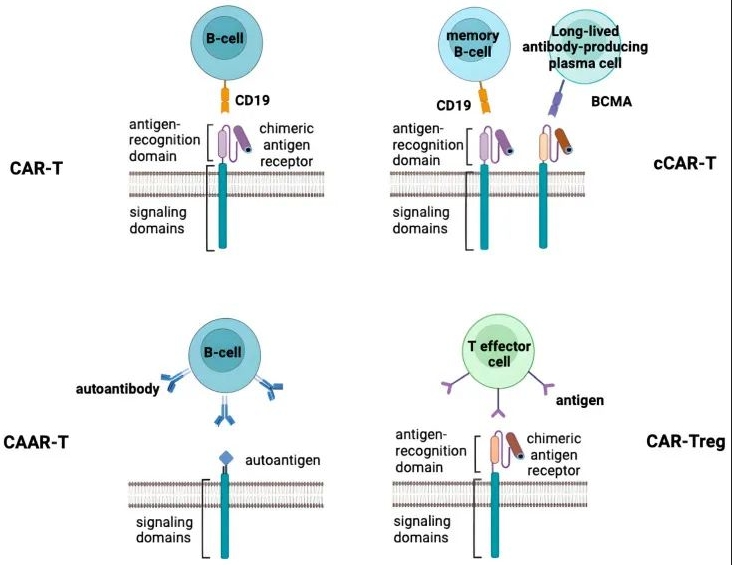
图1:上图展示了上文所述的CAR-T治疗自身免疫性疾病的方法。
自免CAR-T竞争格局一览
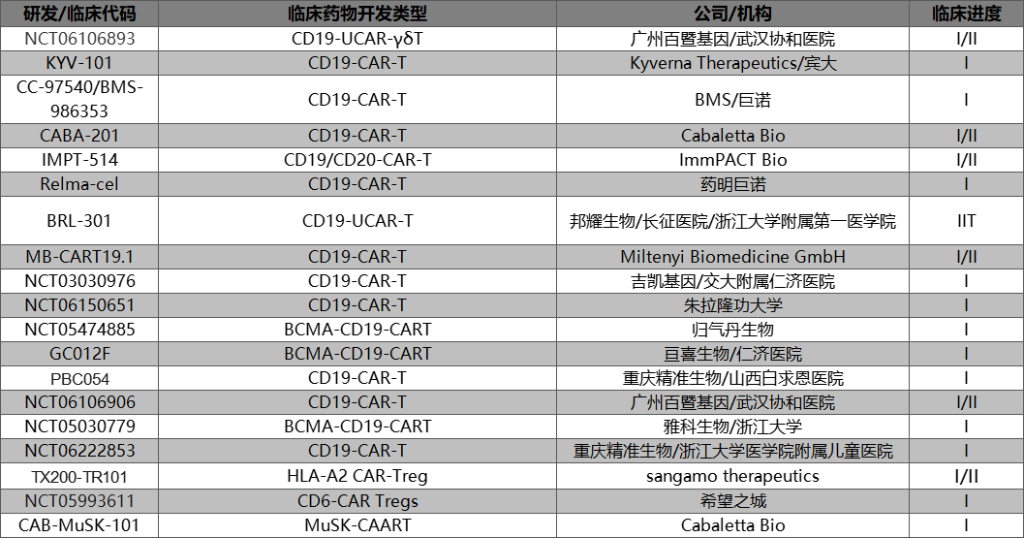
如下图所示,目前自免CAR-T开展的临床试验主要在中美两国,靶点主要是CD19,一部分CD19/BCMA双靶点CAR-T也在同步推进中。
值得一提的是,此前阿斯利康收购亘喜生物的举动其实也补充了阿斯利康的自身免疫管线。同样布局自免CAR-T的大厂还有收购了巨诺的BMS。
而在新兴Biotech公司的新注册临床中,百暨基因,邦耀生物,重庆精准,雅科生物等我国企业的出现值得期待。
相比于已经在B细胞自免领域证实疗效的CD19-CAR-T,虽然近年来成立了多家相关公司,但CAR-Tregs目前大都处于临床早期和临床前阶段,适应症开发集中在GvHD上。
必须开发UCAR-T的理由
同样值得关注的是通用型CAR-T在自免领域上的出现,百暨基因和邦耀生物开发的两款CAR-T均为UCAR。
在很多情况,CAR-T被用作针对血液肿瘤的先锋利器,而高昂的价格和成本同样也成为了困扰其普及性的重要阻碍。
这一问题同样出现在自免领域。
这里简单来算一笔经济账,以目前研究较多的系统性红斑狼疮(SLE)为例。
在美国,不开发UCAR-T就能获得收入的逻辑相对走得通,美国平均每例SLE患者每年的疾病花费约为20924美元,而CAR-T价格在40万美元左右,只要接受CAR-T治疗后,能确保20年内不复发,对患者来说就更愿意选择CAR-T。
当然确保不复发是前提,是否能确保不复发,很难得到预知。
而在我国,系统性红斑狼疮每年治疗费用根据病情严重程度而分类,较为轻微的患者每年治疗花费大约在几千元内不等。病情较为严重的患者花费才相对较高,一年的治疗费用可能超过1万元。
如果按照100万-120万CAR-T的价格来计算,相对性价比仍然不高,可能只有出现患者对传统治疗无反应的情况下才会采用CAR-T疗法。
在这种情况下开发价格更低的UCAR-T就成为了解决问题的可能方案。
总结
在目前CAR-T赛道大量临床集中在肿瘤的情况下,向自免领域开发是避免内卷的方法之一,而这一领域不光是靶点,模式,修饰的细胞和靶向的细胞,都有进一步的开发可能性。
参考来源:
Chasov V, Zmievskaya E, Ganeeva I, Gilyazova E, Davletshin D, Khaliulin M, Kabwe E, Davidyuk YN, Valiullina A, Rizvanov A, Bulatov E. Immunotherapy Strategy for Systemic Autoimmune Diseases: Betting on CAR-T Cells and Antibodies. Antibodies (Basel). 2024 Feb 1;13(1):10. doi: 10.3390/antib13010010. PMID: 38390871; PMCID: PMC10885098.
Reincke SM, von Wardenburg N, Homeyer MA, Kornau HC, Spagni G, Li LY, Kreye J, Sánchez-Sendín E, Blumenau S, Stappert D, Radbruch H, Hauser AE, Künkele A, Edes I, Schmitz D, Prüss H. Chimeric autoantibody receptor T cells deplete NMDA receptor-specific B cells. Cell. 2023 Nov 9;186(23):5084-5097.e18. doi: 10.1016/j.cell.2023.10.001. Epub 2023 Nov 1. PMID: 37918394.